近日,伟德国际1946官方网中西秀树教授团队高晓冬课题组在关于真核细胞N-糖基化修饰的基础研究中取得进展,研究成果“Rft1 catalyzes lipid-linked oligosaccharide translocation across the ER membrane”在线发表于Nature Communications(https://doi.org/10.1038/s41467-024-48999-3)。
天冬酰胺 (N)-连接的糖基化是真核细胞蛋白质重要的翻译后修饰方式之一,约90%的糖蛋白被N-糖基化修饰。N-糖基化修饰始于内质网(ER)膜上多萜醇寡糖前体(DLO)的装配,首先在ER膜的外侧通过一系列特定的糖基转移酶(Alg)将2个N-乙酰葡萄糖胺(GN)和5个甘露糖(M)依次添加至多萜醇磷酸(Dol-P),形成M5GN2-PP-Dol。随后,M5GN2-PP-Dol通过磷脂双分子层翻转至ER内腔,这种跨膜转运是快速的、不依赖ATP、对蛋白酶敏感,并且具有极高的底物特异性。转运在热力学上是不利的,因为极性的糖基头部必须穿过脂双层的疏水内部。Helenius和Aebi在二十年前报道Rft1可能参与了该过程。然而,迄今为止,糖生物学界对Rft1翻转酶的身份仍存在很大争议。作者通过高拷贝抑制子筛选到了古菌HhAgl23可以回补rft1Δ细胞的致死性状和N-糖基化缺陷。此外,作者还开发了一个体外LLO翻转酶测定法,利用蛋白脂质体和纯化的Rft1或HhAgl23蛋白中确认了M5GN2-PP-Dol的翻转活性。最终确认Rft1翻转M5GN2-PP-Dol的功能。
首先,作者根据序列相似性进行预测,将HsRFT1(人)、TbRFT1(布氏锥虫)、HhRFT1(西班牙盐辉菌)、HvRFT1(火山盐古菌)、HsCLPTM1L(人)和Thermosipho africanus MurJ(细菌),它可以转运与脂质连接的肽聚糖前体以及古生物H. hispanica Agl 23(HhAgl23)转入到rft1Δ酵母菌中,只有HhAgl23能够抑制rft1Δ致死性状。这表明HhAgl23是酵母rft1Δ的真正功能性抑制子(图1)。
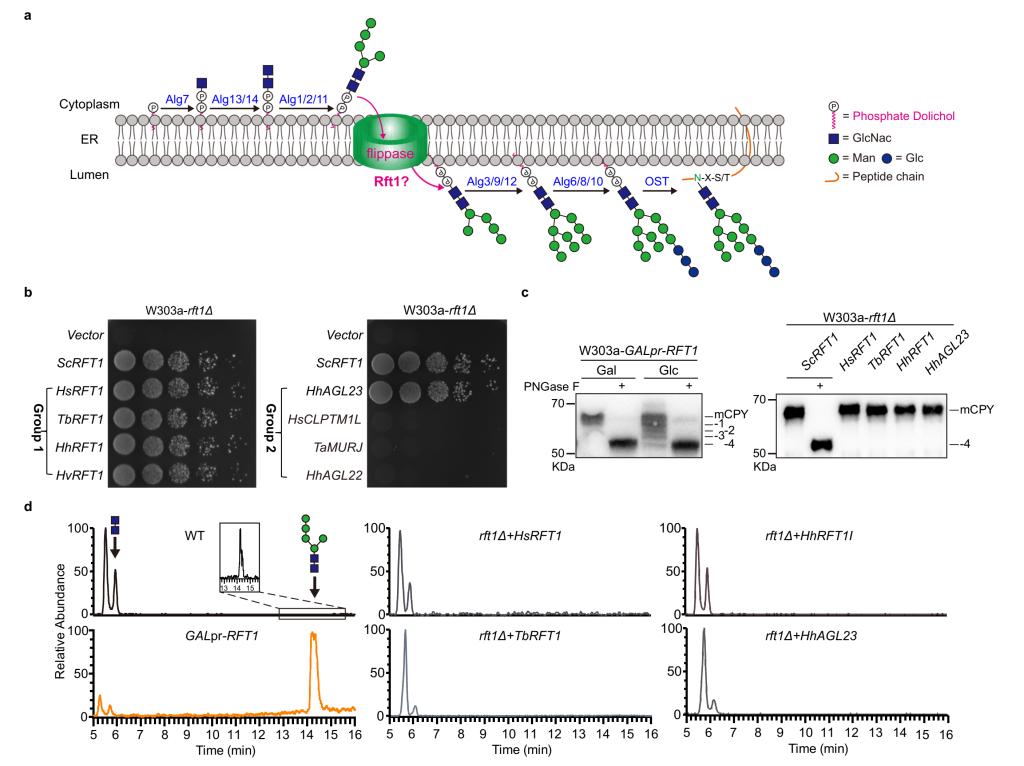
图1 RFT1 缺陷高拷贝抑制子的筛选
为了进一步验证HhAgl23和Rft1在LLO转运过程中的功能,作者建立了一种用于检测M5GN2-PP-Dol翻转活性的体外测定法。利用鸡蛋磷脂酰胆碱(PC)和脑磷脂酰丝氨酸(PS)生成的脂质体,并含有合成的植物醇丁烷基焦磷酸盐M5GN2(M5GN2-PP-Phy)底物。在这些脂质体中,M5GN2-PP-Phy在内外膜层之间呈随机分布,大约一半的寡糖面对腔内,另一半面对外部。外部的α1,2连接的甘露糖应该可以被甘露糖苷酶切割,而腔内的甘露糖是不可接近的,因此受到保护而不受切割。在α1,2甘露糖苷酶存在或不存在的情况下对脂质体进行的UPLC-MS分析证实,该处理导致了M5GN2预测转化为M3GN2,其中M3GN2占寡糖的50%。为了确定Rft1或HhAgl23是否催化M5GN2-PP-Phy的转位,我们试图在不含ATP的反应中,利用纯化的ScRft1或HhAgl23重组脂质体,并用α1,2甘露糖苷酶进行处理。包含ScRft1或HhAgl23的蛋白质脂质体中的M5GN2与M3GN2的比值减少。不含蛋白质的脂质体或含有与之并行纯化的非相关蛋白质(H. hispanica,HhAgl22)的蛋白质脂质体在1小时时间点后维持了大约50%的M5GN2与M3GN2的稳定比率(图2)。实验表明,无论是Rft1还是古生物HhAgl23都能够在体外催化M5GN2-PP-Phy的转位。
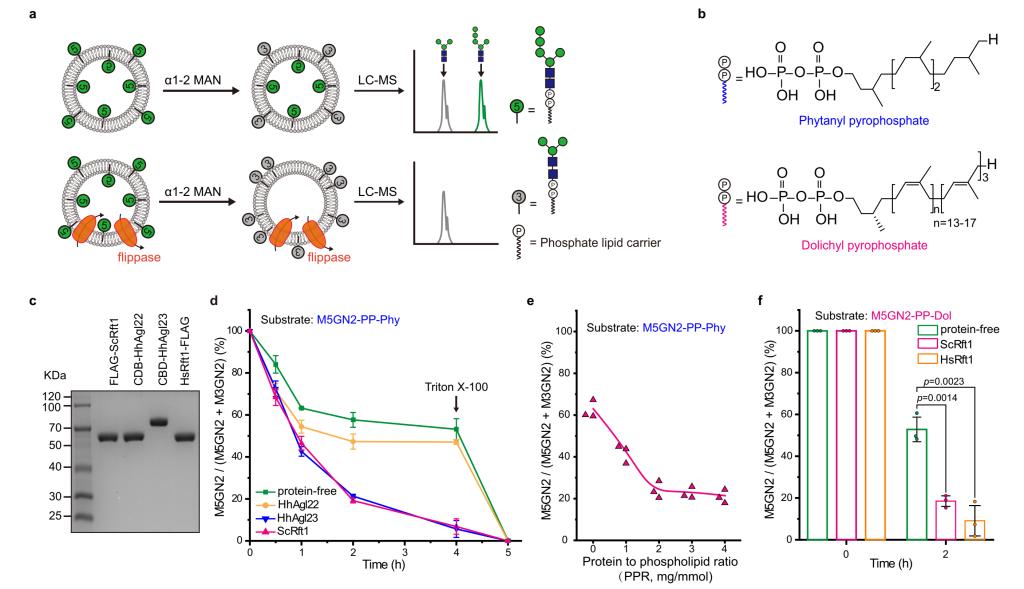
图2 Rft1和HhAgl23体外翻转酶活测定
LLO生物合成途径中胞质定位的甘露糖基化步骤包括M1、M2、M3、M4和M5GN2-PP-Dol中间体的逐步合成。M5GN2-PP-Dol的两个关键属性是其ER定位和与其他LLO中间体相比,其对胞质M5GN2-PP-Dol的优先识别。为了测试ScRft1的底物特异性,作者在含有M3GN2-PP-Phy作为底物的脂质体中测定了其翻转酶活性。为了测定这些含有M3GN2-PP-Phy的脂质体,作者使用α1-2,3甘露糖苷酶将M3GN2转化为M2GN2作为定量转位的读数。在存在或不存在α1-2,3甘露糖苷酶的情况下,对这些脂质体制备的寡糖进行的UPLC-MS分析表明,这种处理导致了M3GN2到M2GN2的预期转化,其中M2GN2占寡糖的50%。重新组装了纯化的ScRft1的蛋白质脂质体显示M3GN2到M2GN2比率没有下降,在经过4小时孵育后,仍有50%的M3GN2保留。相反,在含有HhAgl23的蛋白质脂质体中,少于15%的M3GN2保留,验证了HhAgl23的M3GN2-PP-Dol翻转活性。这些结果表明,与HhAgl23不同,ScRft1可以更有效地跨膜转位M5GN2-PP-Phy,而不是M3GN2-PP-Phy,表明其对M5GN2胞质LLO中间体具有很强的偏好性(图3)。
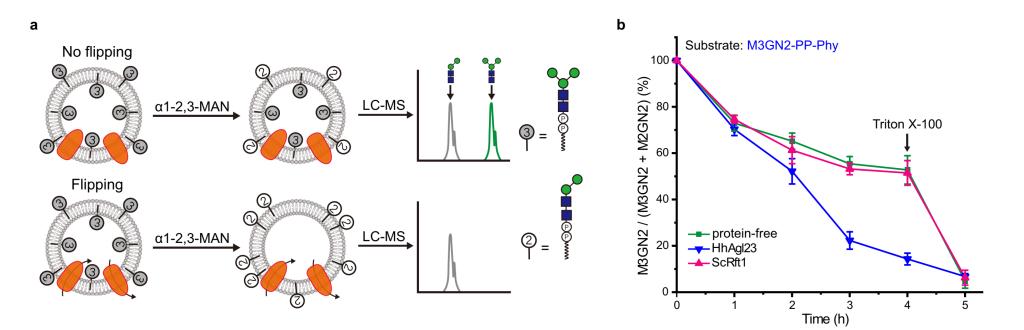
图3 Rft1底物偏好性分析
高晓冬教授、微生物所真菌国家重点实验室金城教授和美国Neta Dean教授是本文论的通讯作者;我院2018级博士生陈帅是该论文的第一作者。该工作得到了国家自然科学基金(31971216,32271342)、轻工业技术与工程国家一级学科计划(LITE2018-015)、山东省重大科技创新项目(2019JZZY011006)等的支持。
