近日,Nucleic Acids Research在线发表了伟德国际1946源于英国未来食品科学中心和伟德国际1946官方网陈坚院士团队刘龙教授课题组的研究成果“Multiplexed in-situ mutagenesis driven by a dCas12a-based dual-function base editor”(Wu et al., Nucleic Acids Res., 2024, 52, 4739–4755)。刘龙教授为论文通讯作者,武耀康副教授为第一作者。
基因多样性是产生各种独特生物学功能的基础,通过诱变方式产生的遗传多样性对于生物系统的深入理解和工程化改造具有重要意义。
PACE
、
OrthoRep
和
MutaT7
等工具可对插入到噬菌体或质粒中的目标基因进行高效诱变,但却无法作用于基因组的原始位点,而基于特定功能结构域的
CRISPR
衍生工具则可以实现基因组的靶向原位诱变。例如,
EvolvR
系统通过将易错的
DNA
聚合酶与
Cas9
切口酶(
nCas9
)相结合,能够在基因组的靶向位点产生随机突变,但其碱基替换频率相对较低(约
1%
);此外,通过将细胞苷酸脱氨酶和腺苷酸脱氨酶与
nCas9
进行融合,开发出的双功能碱基编辑器能够在基因组的目标靶点高效地实现
C
到
T
(
C>T
)和
A
到
G
(
A>G
)的碱基转换。
Cas12a
相较于
Cas9
在多位点靶向方面具有显著优势,通过其
RNase
活性可以从
CRISPR
阵列中加工产生多个
crRNAs
,进而引导其特异性的靶向至基因组的相应位点。然而,基于
Cas12a
的双功能碱基编辑器目前尚未得到验证。
针对以上问题,伟德国际1946源于英国食品合成生物学与生物制造团队研究人员基于
dCas12a
(
DNase
失活的
Cas12a
)设计创制了一种高效的双功能多靶向碱基编辑器
MultiduBE
,并将其应用于基因组的多重原位诱变以生成多种独特的生物表型(图
1
)。首先,通过分析不同来源的胞嘧啶脱氨酶或腺嘌呤脱氨酶与
dCas12a
之间的匹配性,发现当三种胞嘧啶脱氨酶(
hAPOBEC3A
、
hAID*
△
和
LjCDA1L2_1
)及一种腺嘌呤脱氨酶(
TadA9
)与
dCas12a
相融合后,能够同时保证高效的多位点靶向与碱基编辑活性(图
2
);在此基础上,通过功能结构域之间的排列组合优化,获得了可在单一
crRNA
阵列引导下同时靶向基因组不同位点的双重碱基编辑效应蛋白
duBE-1a
与
duBE-2b
(图
3A
),进一步优化效应蛋白的启动子(图
3B
)并在
crRNA
阵列中引入人工间隔序列
Sp4
(图
3C
),实现了大肠杆菌和枯草芽孢杆菌中
5
个不同基因组位点的同步多重原位诱变;最后,在相应的
crRNA
阵列的指导下,
MultiduBE
被成功应用于细胞生理重编程和代谢调控,获得了具有四种抗生素抗性的枯草芽孢杆菌突变菌株(包含一种从未报道的新型链霉素抗性突变,图
4
),且组合突变菌株的表面活性素和核黄素产量分别提高了
42%
和
15
倍(图
5
)。综上所述,
MultiduBE
系统具有高效的基因组多重原位诱变能力,能够在单个
crRNA
阵列的引导下产生丰富的遗传和表型变异,在全基因组范围的诱变研究以及多基因互作分析中展现出了巨大的应用前景和潜力。
MultiduBE
系统相关质粒已存储于
MolecularCloud
质粒共享平台,可通过编号
MC_0101390~MC_0101405
、
MC_0101449~MC_0101454
获取。
上述研究工作得到了国家重点研发计划项目(
2020YFA090830
、
2018YFA0900300
)、国家自然科学基金(
32021005
、
32070085
、
31930085
、
32300064
)、博士后创新人才支持计划(
BX2021113
)、江苏省自然科学基金(
BK20221083
)等项目的资助。
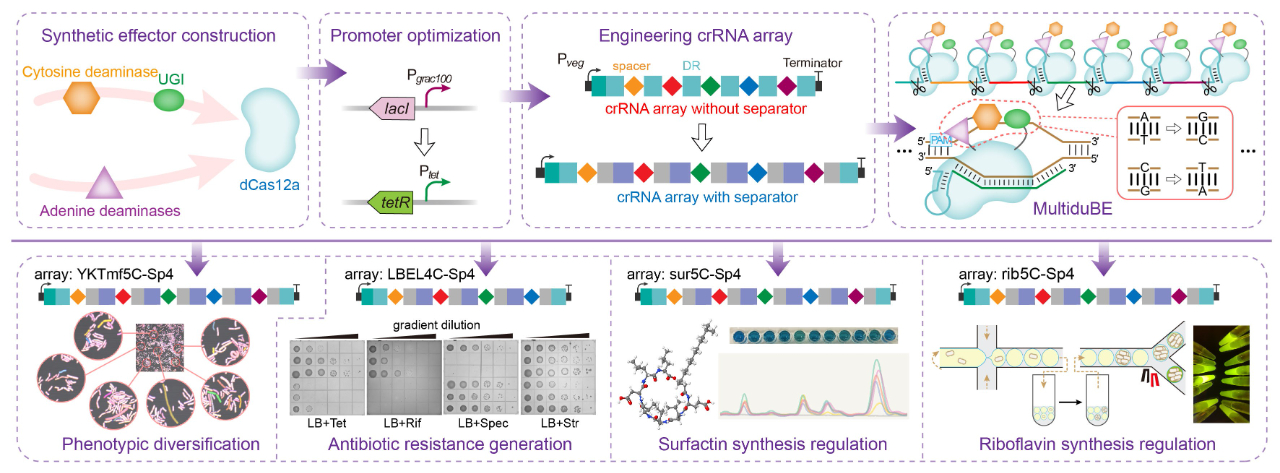
图1 基于dCas12a的双功能多靶点碱基编辑器MultiduBE的设计、创制及应用
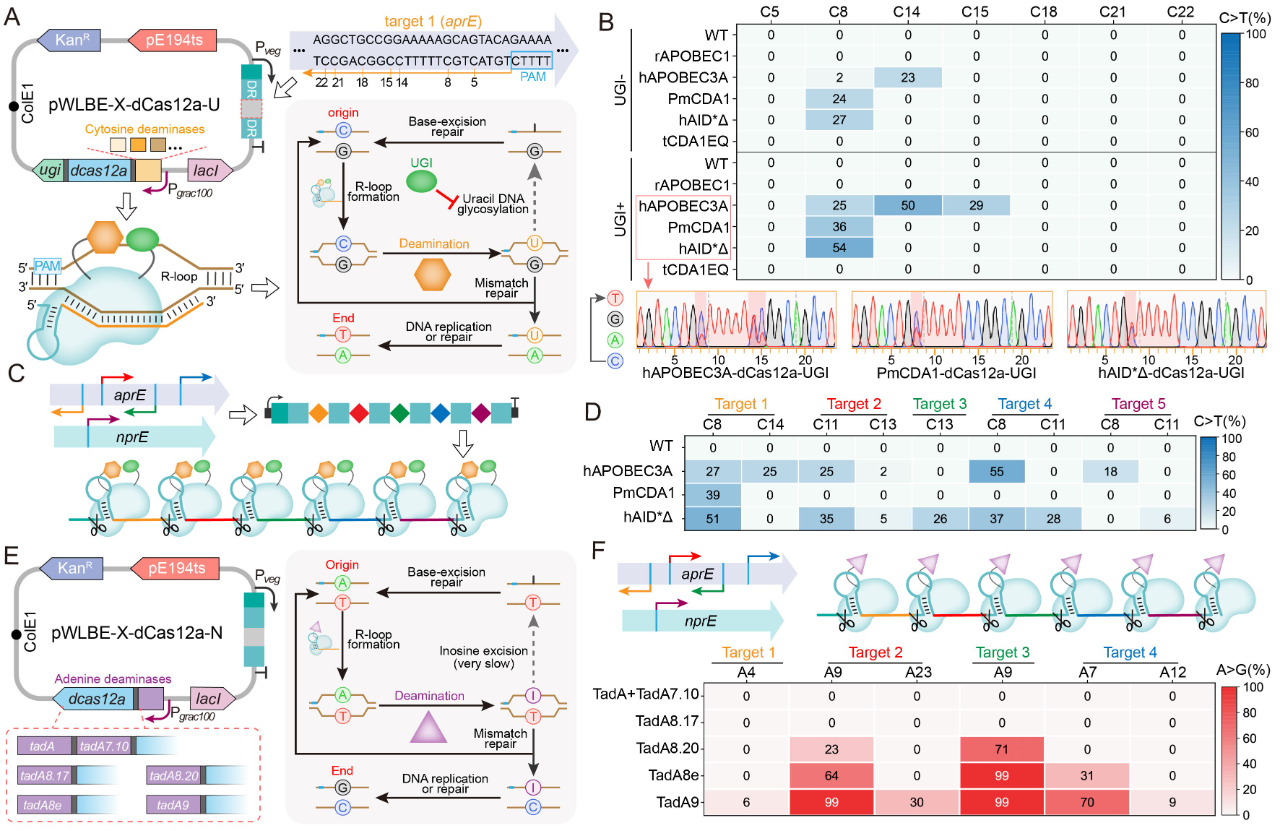
图2 胞嘧啶脱氨酶或腺嘌呤脱氨酶与dCas12a的匹配性表征
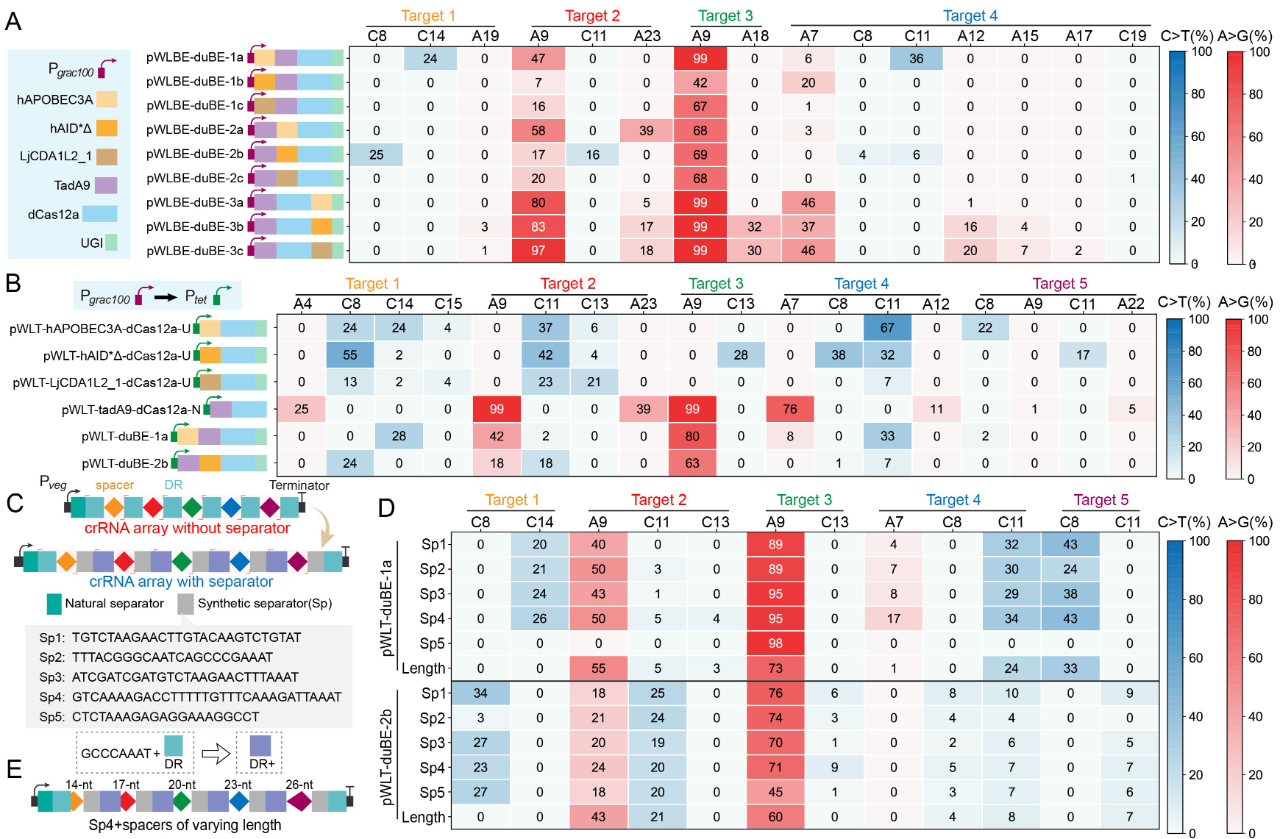
图3 MultiduBE系统的构建与优化
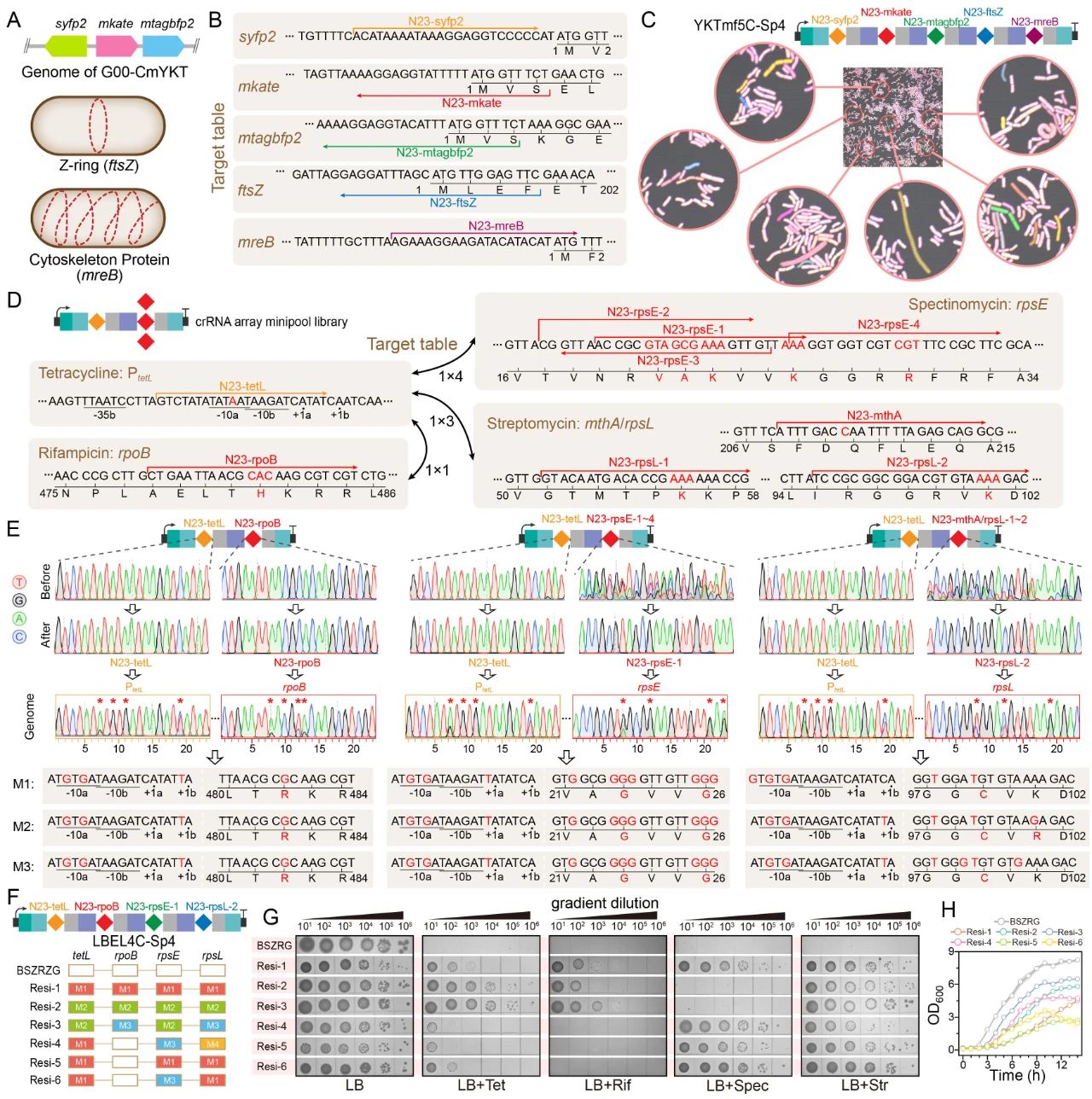
图4 MultiduBE系统在细胞生理重编程中的应用
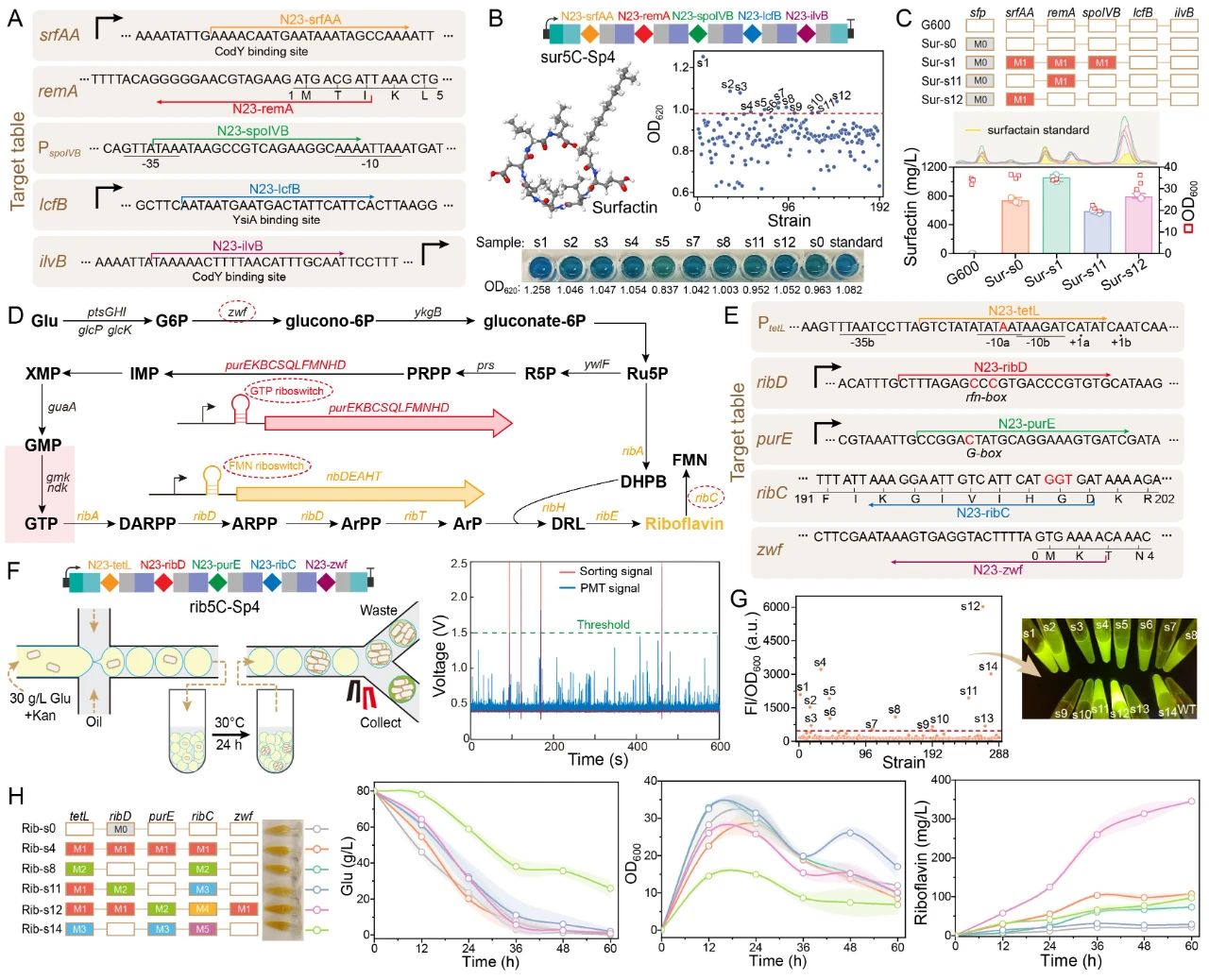
图5 MultiduBE系统在细胞代谢调控中的应用
